مطالب آموزشی
الکترودهای مرجع غیر آبی
الکترودهای مرجع غیر آبی
در هنگام انجام آزمون های الکتروشیمیایی در برخی موارد محیط آزمایش محیطی غیر آبی خواهد بود.
کار کردن در این محیط ها نکات و ویژگی های مخصوص به خود را داشته که در ادامه به بررسی برخی از مهمترین این نکات می پردازیم.
۱-تعریف و انواع محیط غیر آبی
به صورت خیلی ساده می توان گفت محلول غیر آبی محلولی است که در آن حلال مایعی به جز آب می باشد.
بنا بر یک تقسیم بندی می توان انواع حلاهای غیر آبی (و حتی آبی) را به چهار دسته زیر تقسیم کرد:
- حلال Aprotic
- حلال Protophilic
- حلال Protogenic
- حلال Amphiprotic
حلال Aprotic:
حلال های بدون پروتون، حلال هایی هستند که توانایی تشکیل دادن پیوند هیدروژنی را ندارند یا Hydrogen bond donor نیستند.
به بیان دیگر در این حلال ها هیچ اتم هیدروژنی به صورت کوالانسی به یکی از اتم های اکسیژن، نیتروژن یا فلوئور متصل نبوده و بنابراین امکان تشکیل پیوند هیدروژنی ندارند.
مثال هایی از این حلال ها عبارتند از: استون، DMSO، DMF که قطبی بوده و حلالی مانند بنزن که در این گروه قرار گرفته و غیر قطبی می باشد.
حلال Protophilic:
حلال های پروتون دوست، حلال هایی هستند که عموما نقش بازی ایفا می کنند.
این ترکیبات در واکنش با یک اسید تمایل به دریافت پروتون ( یون هیدروژن یک بار مثبت) دارند.
مثال هایی از این حلال ها عبارتند از: آمونیاک، پیریدین و …
حلال Protogenic:
بر خلاف حلال های پروتون دوست این حلال ها در نقش اسید تمایل به از دست دادن و اهدای پروتون دارند.
اسیدهای آلی و معدنی مهمترین اجزای تشکیل دهنده این گروه می باشند.
حلال Amphiprotic:
این حلال ها بنا به برخی تعریف ها دوگانه دوست بوده و می توانند به عنوان دهنده و گیرنده پروتون رفتار کنند.
از مهمترین ویژگی های این حلال ها می توان به توانایی خود یونش آن ها ( مانند آب) اشاره نمود.
مهمترین انواع این حلال ها عبارتند از: الکل ها، آمینو اسیدها و استیک اسید.
۲- الکترود مرجع در محیط های غیر آبی
الکتروشیمی با پدیده هایی مرتبط با جداسازی و انتقال بار سروکار دارد.
این پدیده ها به صورت هوموژن در محلول و یا به صورت هتروژن در سطح مشترک محلول و الکترود رخ می دهند.
برای انجام واکنش های الکتروشیمیایی عموما به محیط های هادی جریان (قطبی) نیاز هست.
امروزه روش هایی برای انجام آزمون های الکتروشیمایی در محیط های غیر قطبی و با ثابت دی الکتریک پایین نیز ابداع شده است.
در صورت انجام واکنش های الکتروشیمایی در محیط هایی غیر آبی باید در تجهیزات آزمایش تغییراتی ایجاد نمود.
الکترودهای مرجع مهمترین اجزایی از یک سل الکتروشیمیایی هستند که برای انجام آزمایش در محیط غیر آبی باید بهینه شوند.
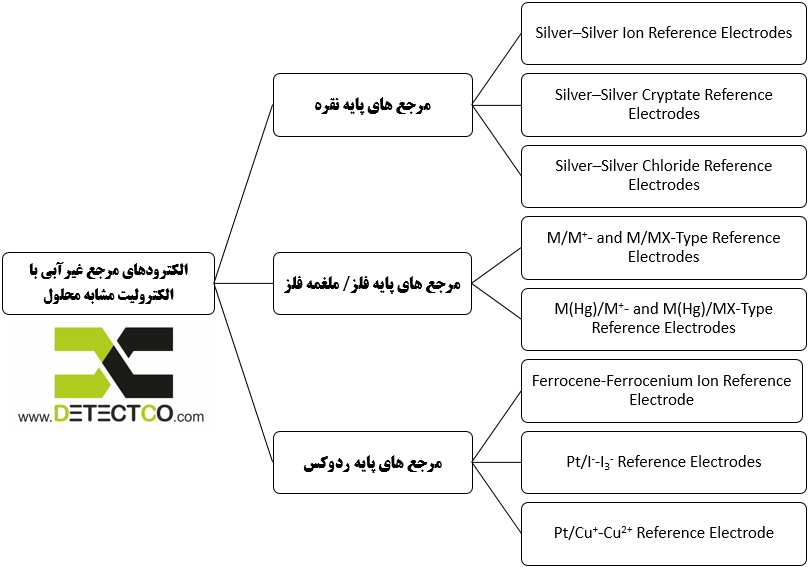
الکترودهای مرجع در محیط غیر به دو گروه کلی تقسیم می شوند:
- الکترودهایی با الکترولیت درونی مشابه با محلول آزمایش
- الکتروهایی با الکترولیتی متفاوت از محلول آزمایش
ساختار کلی این الکترودها مشابه یک الکترود مرجع آبی بوده و دارای یک غشا متخلخل هستند.
در ساخت این الکترودها می توان از یک پل نمکی برای حفاظت بیشتر الکترود در برابر محیط آزمایش استفاده نمود.
الف – الکترودهای مرجع غیر آبی با الکترولیت مشابه محلول آزمایش
در صورت تمایل به استفاده از محلول آزمایش این الکترودها باید شرایط و ویژگی های زیر را دارا باشد:
۱- پتانسیل آن تکرار پذیر بوده و در گذر زمان ثابت باشد.
۲- واکنش درونی آن تکرار پذیر بوده و از معادله نرنست پیروی کند.
۳-در صورت عبور جریان اندکی از الکترود و قطع آن پتانسیل بتواند به مقدار اولیه برگردد.
۴- تغییرات شدیدی در پتانسیل با تغییرات دما ایجاد نشود.
این الکترودها انواع بسیار زیادی دارند ولی بر اساس زوج اکسایش احیا (ردوکس) داخلی به چند گروه مهم تقسیم می شوند:
رایج ترین الکترود در بین الکترودهای فوق الکترود نقره/یون نقره (از خانواده مرجع های پایه نقره) می باشد.
در این الکترود پایه یون نقره نمک نیترات نقره یا پرکلرات نقره بوده و از حلال استونیتریل به عنوان الکترولیت استفاده می شود.
باید دقت نمود که این الکترودها به شدت به ناخالصی و آب حساس هستند.
مقادیر بسیار اندک از این موارد پتانسیل را به راحتی چندین میلی ولت جا به جا می نماید.
در شکل زیر به عنوان نمونه ساختار یک الکترود نقره / یون نقره مشاهده می گردد:
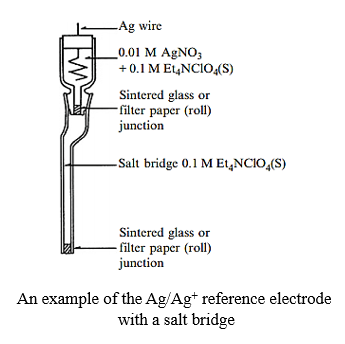
همانند الکترودهای مرجع آبی پتانسیل الکترودهای مرجع غیر آبی بر اساس نوع و غلظت الکترولیت داخلی و شرایط محیطی (مانند دما) تغییر میکند.
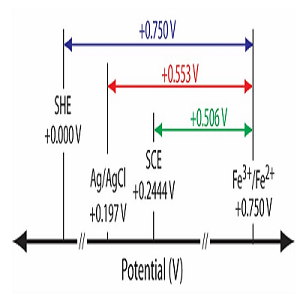
برای دانستن پتانسیل الکترود می توان از جداول استاندارد مشابه جدول زیر استفاده نمود:
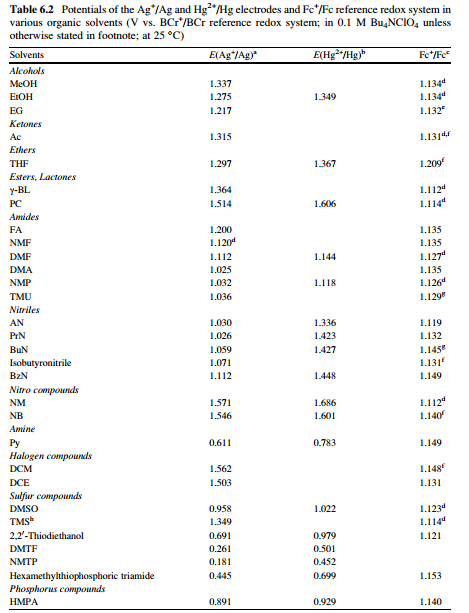
ب – الکترودهای مرجع غیر آبی با الکترولیت متفاوت با محلول آزمایش
این الکترودهای مرجع در واقع همان الکتردهای رایج و آشنای محیط های آبی هستند.
مهمترین این الکترودها الکترود مرجع نقره/کلرید نقره و کالومل می باشند.
برای استفاده از این الکترودها عموما قسمت نوک آن ها را در یک پل نمکی حاوی الکترولیت غیر آبی قرار می دهند.
در مورد الکترودهای فوق الکترولیت که در الکترود استفاده می شود در سطح تماس با محیط غیر آبی به تدریج از حالت محلول خارج و باعث گرفتگی غشای الکترود می گردد.
بنابراین به جهت استفاده از الکترودهای آبی در محیط غیر آبی حتما باید از پل های نمکی حاوی محلول های غیر آبی استفاده نمود.
این کار از گرفتگی غشا و آلوده شدن محیط آزمایش جلوگیری خواهد کرد.
به عنوان مثال اکثر محلولهای آلی فلزی شدیدا با آب واکنش می دهند.
روش دیگر برای استفاده از الکترودهای مرجع آبی در محیط غیر آبی استفاده از Luggin capillary است.
با قرار دادن الکترود مرجع در این لوله امکان نزدیک کردن آن به الکترود کار فراهم می شود.
این روش باعث کاهش مقاومت محلول موجود بین الکترود کار و مرجع می گردد.
در این روش برای به دست آوردن داده های تکرار پذیر به فاصله و مکان قرار گیری لوله مویین باید بسیار توجه نمود!
نزدیک کردن بیش از اندازه لوله مویین به الکترود کار باعث ممانعت از جابه جایی درست محلول خواهد شد!